
IRIS SARS COV-2 IgM /
IgG-ANTIKÖRPERTEST-KIT



Das Iris Sars Cov-2 IgM / IgG-Antikörpertest-Kit ist ein Schnelltest zum qualitativen Nachweis von IgM- und IgG-Antikörpern gegen SARS-CoV-2 in menschlichem Vollblut (aus einer Vene oder Fingerspitze entnommen), Serum oder Plasma.
MEHR
IRIS SARS CoV-2 IgG IgM Rapid Test
Technical Report and Clinical Data Analysis
1.0 Introduction
IRIS SARS CoV-2 IgG IgM Rapid Test Technical Report and Clinical Data Analysis
The IRIS SARS CoV-2 IgG IgM is a colloidal gold-based immunochromatographic strip assay produced by Alpha Pharma Industry (Bari, Italy). The test is rapid (10-14 min) and is based on a lateral flow immunoassay targeted to evaluate the presence or absence of anti-SARS-CoV-2-IgM and anti-SARS- CoV-2-IgG. The test is validated for different human specimens: capillary blood, venous whole blood, serum and/or plasma.
The IRIS SARS CoV-2 IgG IgM utilizes Anti-human IgG and anti IgM against the Receptor-Binding Domain of the COVID-19 spike protein recombinant antigen. The strip test consists by a nitrocellulose membrane incorporating mouse anti-human-IgM and IgG monoclonal antibody, plus anti-rabbit-IgG immobilized in different position (M and G lines) and in control line (C line), respectively.
The use of the test is extremely simple and rapid: the sample (10-15 ul) is deposited in sample-port and few second later 2 drops are added (the buffer is supplied together with the test in a dropper bottle). The blood macromolecules are moved forward by capillarity and "walk" along the nitrocellulose strip which has been absorbed by a mixture of recombinant antigen AuNP-COVID-19 and AuNP-rabbit-IgG. If anti-SARS CoV-2 IgM antibodies are present in the patient's blood, they bind to the viral antigen labelled with colloidal gold, then forming a sandwich with the anti-human IgM monoclonal antibody (present only on one line marked by the letter M); in this case the line will turn pink-red. Similarly, for IgG, in a second line in which monoclonal antibodies to human IgG are present.
If both lines are not dyeing, the test will be considered as negative; vice versa the development of a coloured band (even if not very intense) on the IgG and/or IgM line indicates the presence of anticovid antibody in the patient blood and the test will be considered positive. The device also contains a quality control line C, which must always colour and check that the kit is working properly.
2.0 Experimental data results
2.1.1 Preliminary test on sensitivity and specificity
Test are performed in the clinical setting of Catanzaro Lido Polyclinic (Dr Maurizio Cipolla, MD, Pathologist) in cooperation with the Catanzaro Hospital (Dept of Infectious Diseases) for the RT-PCR execution according with the Italian Government Guide Lines.
Sample size 15 adults of both sexes, aged 30-70 yr., with suspected diagnosis of Covid19 infection.
Operating Procedures: IRIS SARS CoV-2 IgG IgM test execution in the same day of pharyngeal swab for RT-PCR detection of Covid-19 according with WHO guideline and procedure advised by Regione Calabria and Italian Health Ministry. IRIS SARS CoV-2 IgG IgM test samples: capillary blood Statistics: non parametric test (Cohen’s K and exact McNemat test). Probability of Agreement, Concordance, and Cohen’s K categorization according to DG Altman and R. Kwiecien1
The Results for IgG test: Cohen's k = 1.000; exact McNemar test: p > 0.999. Sensitivity 100,0% (95% Intervals of Confidence= 39.7-100.0). Specificity 100,0% (95%IC= 71,5-100.0).
Results for IgM test Cohen's k = 0.842; exact McNemar test: p > 0.99. Sensitivity 100,0% (95% Intervals of Confidence= 39.7-100.0). Specificity 90,1% (95%IC= 58.7-99.7).
2.1.2 Final test on sensitivity and specificity
The tests were performed as previously described (see 2.1.1). The overall sample (pooled data) consists of 161 adult subjects of both sexes
2.1.2.1 IgM results: Cohen's k = 0.963, McNemar exact test: p > 0.9999.
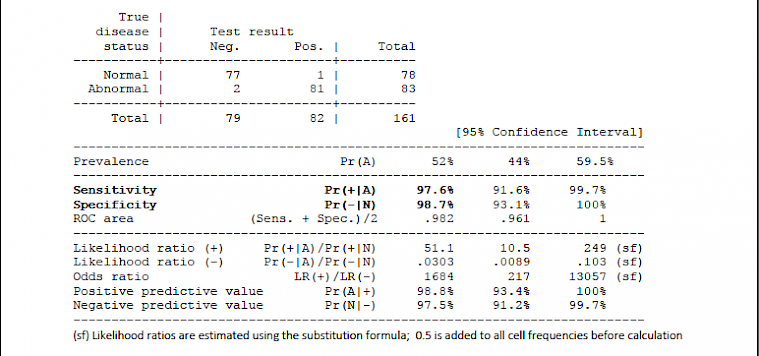
2.1.2.2 IgG results: Cohen's k = 0.963, McNemar exact test: p = 0.2500

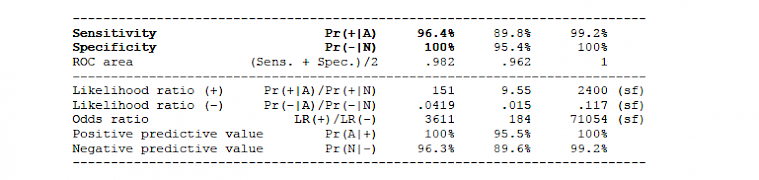
2.2.1 Clinical protocol (in- and out-patients)
Test are performed in the clinical setting of San Camillo Forlanini Hospital in Rome (Dr Gabriella Parisi) (Dept of Microbiology and Virology). The PCR test are performed according with Italian Istituto Superiore di Sanità (ISS) and Italian Health Ministry guideline and recommendations
Sample size 365 patients selected on the basis of the symptoms or candidate to surgery, from the Emergency, Surgery and Internal Medicine Departments. Patients of both sexes (no age-based exclusion criteria) with suspected diagnosis of Covid19 infection or candidate to the PCR before admission to surgery.
Operating Procedures: IRIS SARS CoV-2 IgG IgM test execution within 36-48 hrs before or after pharyngeal swab for RT-PCR detection of Covid-19 according with WHO guideline and procedure advised by ISS and Italian Health Ministry. IRIS SARS CoV-2 IgG IgM test samples: venous whole blood or plasma after REB separation by centrifugation.
Results:
On 365 patients, 353 showed the same results both with PCR and IRIS SARS CoV-2 test. The concordance rate resulted of 97%. In 12 patients with discordant results, 7 resulted negative to the RT-PCR and positive for IgM only (n=6), for IgM and IgG (n=1<) while the RT-PCR resulted negative (see footnote 1, previous page). After a second oropharyngeal swab for RT-PCR second control performed on discordant patients, 5 patients tested positive to RT-PCR, thus the used test gave a 98.1% (358/365) concordance (e.g., accuracy), with an expected CI95% from 96.1% to 99.2%
2.2.2 Healthcare personnel survey
Test are performed on the Doctors and Nurses of the San Camillo Forlanini Hospital in Rome (Dr Gabriella Parisi, Dept of Microbiology and Virology). The PCR test are performed as previously described.
Sample size 180 doctors and nurses selected among the San Camillo-Forlanini Hospital healthcare personnel (adults, both sexes) on the basis of risk exposition to Covid-19 infection.
Operating Procedures: IRIS SARS CoV-2 IgG IgM test execution together with the pharyngeal swab for RT-PCR detection of Covid-19, according with WHO guideline and procedure advised by ISS and Italian Health Ministry. IRIS SARS CoV-2 IgG IgM test samples: venous whole blood or plasma and/or capillary blood.
Results: concordant results were documented in 176/180 hospital employees, the accuracy was 97.8% (176/180), with an expected CI95% from 94.4% to 99.4%. Discordant results (n=4): 1 false negative results -for both IgM and IgG rapid test- with positive oropharyngeal swab; 2 false negative of RT-PCR; one was classified as "doubtful IgM positivity" (due to the difficulty of reading the IgM band): this patient had a positive PCR test and certainly negative IgG band and should be included among the possible false negatives of the rapid test.
*** * ***
The test carried on the whole San Camillo sample (patients plus health workers) gave a 97.8% accuracy, with an expected CI95% ranging from 96.2% to 98.9%.
2.3 IRIS SARS CoV2 test in the setting of the occupational medicine and industry worker protection
Tests were carried out on the employees of a company (Sorical SPA, General manager Pia Chiarella) working in the field of drinking water and water supplies of almost all the Calabrian municipalities. The aim is checking all employees of the industry (continuous monitoring of Covid-19 infection by rapid test and quarantine any COVID-19 positive employee).
Operating Procedures: all employees were invited to take the IRIS SARS CoV-2 IgG IgM rapid test during working hours, inside the factory. The test was repeated every 15 days. Employees were also given a computerized Covid card (with information on their health, co-morbidity and any symptoms present) and the data were sent to the competent doctor. The RC-PCR test was performed only if the rapid test was positive.
Sample size: 172 healthy employees (aged 20-70, males and females) were tested. At present two controls were performed (total 344 IRIS SARS CoV-2 tests).
Results: only 1 case resulted positive to the IgM test (IgG negative, first RT-PCR test negative): the employee was released from the work (quarantine) waiting the second RT-PCR test in accordance with the Italian legal provisions and with the guidelines. No new cases of seroconversion were detected during the first phase of the follow up.
3.0 Conclusions
The IRIS SARS-CoV-2 IgG / IgM rapid test has a very high sensitivity and specificity; has been successfully used in different settings, for monitoring and diagnosing patients (belonging to General Medicine, Emergency Dept or Internal Medicine) and for the periodic survey of industrial and healthcare personnel.
We consider this test valid and reliable in several sectors (food industry, hospitals and medical centres, other strategic industries) both for the high sensitivity and specificity (and therefore accuracy) and for the extreme ease of use and reading. In fact, over 900 tests carried out during the study and validation phase in Italy, no cases of difficulty / impossibility of execution were reported, even in non-specialist environments; in only one case was a doubt reported on reading the coloured band.
In our opinion, a test with such high sensitivity and specificity is also indicated for epidemiological purposes on large sections of the population (general population and/or high-risk groups). From a clinical point of view, it is indicated for the diagnosis of Covid19 infection and / or the differential diagnosis with respect to other diseases, according to good clinical practices, which require the doctor to consider all the diagnostic elements (clinic, instrumental, laboratory, included the RT- PCR). Furthermore, the use of the IRIS SARS CoV-2 test can reveal patients with false negative RT- PCR, as suggested by the WHO guidelines and the literature. It should be noted that the execution of the rapid serological test, while not replacing the use of swabs to identify viral RNA, is not operator-dependent and therefore very suitable for the setting of primary care2.
Coordinators of the Scientific Committee
DR. Maurizio Cipolla MD, Pathologist
President of Digital Sit Calabria (Italian Society of Digital Health and Telemedicine Scientific director of the multicronicity plans Regione Calabria (Italy)
Scientific director of Digitcal Srl
Enable JavaScript to view protected content.
Prof. Antonio Vittorino Gaddi, MD, PhD
Research Doctor in Experimental Medicine and Atherosclerosis - Consultant: Cardiology, Geriatrics and Gerontology
Main Investigator of Health Research and Development SrL, IT -Scientific Director of Qi International Ltd, London, UK
Past President of the Medicine and Surgery undergraduate course of the Bologna University -
Past Director, of Giancarlo Descovich Bologna Center of Atherosclerosis and Metabolic Diseases
President of Digital SIT-EMR (Italian Society of Digital Health and Telemedicine, Emilia Romagna Region), Director of Scientific Board of EuroGenLab (BO) and Health-Lab, GT Foundation (MO).
Lugo Medica and Caravelli Lab & EuroGenLab, via Acquacalda 3 (Lugo, RA) and via Zamboni 8, Bologna,051 231531 -mobile+39 3341953354 Enable JavaScript to view protected content. https://www.researchgate.net/profile/Antonio_Gaddi - https://it.wikipedia.org/wiki/Antonio_Vittorino_Gaddi
4.0 References
B. B. Practice, “Coronavirus disease 2019- Situation report 76,” World Heal. Organ., vol. 2019, no. April, p. 2633, 2020, doi: 10.1001/jama.2020.2633.
B. Meyer, C. Drosten, and M. A. Müller, “Serological assays for emerging coronaviruses: Challenges and pitfalls,” Virus Res., 2014, doi: 10.1016/j.virusres.2014.03.018.
C. G. B. Caraguel, H. Stryhn, N. Gagné, I. R. Dohoo, and K. L. Hammell, “Selection of a cutoff value for real-time polymerase chain reaction results to fit a diagnostic purpose: Analytical and epidemiologic approaches,” Journal of Veterinary Diagnostic Investigation. 2011, doi: 10.1177/104063871102300102.
C. Sheridan, “Fast, portable tests come online to curb coronavirus pandemic,” Nat. Biotechnol., 2020, doi: 10.1038/d41587-020-00010-2.
D. Lin et al., “Evaluations of serological test in the diagnosis of 2019 novel coronavirus (SARS-CoV-2) infections during the COVID-19 outbreak,” medRxiv, 2020, doi: 10.1101/2020.03.27.20045153.
DG Altman. Practical statistics for medical research. 1st edition. Oxford: Chapman and Hall. 1991:1– 611.
G. Lippi, A.-M. Simundic, and M. Plebani, “Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019 (COVID-19),” Clin. Chem. Lab. Med., 2020, doi: 10.1515/cclm-2020-0285.
J. P. T. Higgins, S. G. Thompson, J. J. Deeks, and D. G. Altman, “Measuring inconsistency in meta- analyses,” British Medical Journal. 2003, doi: 10.1136/bmj.327.7414.557.
J. Xiang et al., “Evaluation of Enzyme-Linked Immunoassay and Colloidal Gold- Immunochromatographic Assay Kit for Detection of Novel Coronavirus (SARS-Cov-2) Causing an Outbreak of Pneumonia (COVID-19),” medRxiv, 2020, doi: 10.1101/2020.02.27.20028787.
J. Zhang et al., “Serological detection of 2019-nCoV respond to the epidemic: A useful complement to nucleic acid testing,” medRxiv, 2020, doi: 10.1101/2020.03.04.20030916.
J. Zhao et al., “Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019,” medRxiv, 2020, doi: 10.1101/2020.03.02.20030189.
L. Lan et al., “Positive RT-PCR Test Results in Patients Recovered From COVID-19.,” JAMA, 2020, doi: 10.1001/jama.2020.2783.
L. Liu, W. Liu, S. Wang, and S. Zheng, “A preliminary study on serological assay for severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in 238 admitted hospital patients,” medRxiv, 2020, doi: 10.1101/2020.03.06.20031856.
M. El-Tholoth, H. H. Bau, and J. Song, “A Single and Two-Stage, Closed-Tube, Molecular Test for the 2019 Novel Coronavirus (COVID-19) at Home, Clinic, and Points of Entry,” 2020, doi: 10.26434/CHEMRXIV.11860137.V1.
P. Winichakoon et al., “Negative Nasopharyngeal and Oropharyngeal Swab Does Not Rule Out COVID-19.,” J. Clin. Microbiol., 2020, doi: 10.1128/JCM.00297-20.
P. Zhang et al., “Evaluation of recombinant nucleocapsid and spike proteins for serological diagnosis of novel coronavirus disease 2019 (COVID-19),” medRxiv, 2020, doi: 10.1101/2020.03.17.20036954.
Q. Li et al., “Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia,” N. Engl. J. Med., pp. 1199–1207, 2020, doi: 10.1056/nejmoa2001316.
Q. Y. Gao, Y. X. Chen, and J. Y. Fang, “2019 Novel coronavirus infection and gastrointestinal tract,” Journal of Digestive Diseases. 2020, doi: 10.1111/1751-2980.12851.
R. Porcheddu, C. Serra, D. Kelvin, N. Kelvin, and S. Rubino, “Similarity in Case Fatality Rates (CFR) of COVID-19/SARS-COV-2 in Italy and China,” J. Infect. Dev. Ctries., 2020, doi: 10.3855/jidc.12600.
R. Kwiecien, A. Kopp-Schneider, M. Blettner: Concordance Analysis, Dtsch Arztebl Int. 2011 Jul; 108(30): 515–521. doi: 10.3238/arztebl.2011.0515
S. L. Bai et al., “[Analysis of the first cluster of cases in a family of novel coronavirus pneumonia in Gansu Province].,” Zhonghua Yu Fang Yi Xue Za Zhi, 2020, doi: 10.3760/cma.j.issn.0253- 9624.2020.0005.
V. M. Corman et al., “Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR,” Euro Surveill., 2020, doi: 10.2807/1560-7917.ES.2020.25.3.2000045.
W. Wang et al., “Detection of SARS-CoV-2 in Different Types of Clinical Specimens,” JAMA, 2020, doi: 10.1001/jama.2020.3786.
WHO, “Population-based age-stratified seroepidemiological investigation protocol for COVID-19 virus infection,” no. March, pp. 1–19, 2020.
World Health Organization, “Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases,” vol. 2019, no. January, pp. 1–7, 2020.
World Health Organization, “WHO Director-General’s opening remarks at the mission briefing on COVID-19,” https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at- the-media-briefing-on-covid-19---11-march-2020, 2020. .
Z. Li et al., “Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis.,” J. Med. Virol., 2020, doi: 10.1002/jmv.25727.
1 Categorization of values of Cohen’s kappa: >0.20=Poor, 0.21–0.40=Fair, 0.41–0.60=Moderate, 0.61–0.80= Good, 0.81–1.0= Very good
2 Gaddi AV et al: “The strategic alliance between Clinical and Molecular Science in the war against SARS-CoV-2, with the rapid- diagnostics test as an indispensable weapon for front line doctors”. Position paper signed by 28 Health and Research Italian Centers, in submission to Int J Mol Sci.
IRIS SARS COV 2
"Iris Sars Cov 2"
Das Iris Sars Cov-2 IgM / IgG-Antikörpertest-Kit ist ein Schnelltest zum qualitativen Nachweis von IgM- und IgG-Antikörpern gegen SARS-CoV-2 in menschlichem Vollblut (aus einer Vene oder Fingerspitze entnommen), Serum oder Plasma. Der Test ist nur für die In-vitro-Diagnostik und nur für den professionellen Gebrauch bestimmt. Es ist für klinische Labors und zur Verwendung durch medizinisches Fachpersonal nur für Tests vorgesehen, die in Behandlungszentren durchgeführt werden. Es ist nicht für Heimtests vorgesehen.
Das Iris Sars Cov-2 IgM / IgG-Antikörpertest-Kit basiert auf der Immunoassay-Technologie. Das Gerät enthält: 1) Konjugatpuffer: rekombinantes SARS-CoV-2-Antigen, konjugiert mit kolloidalem Gold, gebunden an FITC, FITC-Antikörpern und mit Gold markierten Qualitätskontrollantikörpern. 2) NitroCellulosemembran: ausgestattet mit zwei Nachweisbanden (Bande für IgG und Bande für IgM) und einer Bande zur Qualitätskontrolle (Bande C). Die mit monoklonalen Anti-Human-Ratten-IgM-Antikörpern beschichtete IgM-Bande detektiert IgM-Anti-SARS-CoV-2-Antikörper. Die mit monoklonalen Anti-Human-Ratten-IgG-Antikörpern beschichtete IgG-Bande erkennt IgG-Anti-SARS-CoV-2-Antikörper. Bande C ist zur Qualitätskontrolle mit Antikörpern beschichtet.
Wenn die Blut- / Serum- / Plasmaprobe in die Vertiefung des Geräts gegeben wird, reagiert sie mit den Reagenzien im Gerät. Wenn die eingegebene Probe IgM-Antikörper enthält, bindet sie an das mit kolloidalem Gold markierte virale Antigen, um einen Sandwichkomplex mit dem monoklonalen Anti-Human-IgM-Antikörper zu bilden, der auf die IgM-Bande aufgetragen ist. Die IgM-Bande erscheint purpurrot, was darauf hinweist, dass der SARS-CoV-2-IgM-Antikörper positiv ist. Wenn die eingegebene Probe IgG-Antikörper enthält, bindet sie an das mit kolloidalem Gold markierte virale Antigen und bildet einen Sandwichkomplex mit dem monoklonalen Anti-Human-IgG-Antikörper, der auf die IgG-Bande aufgetragen ist. Die IgG-Bande erscheint purpurrot, was darauf hinweist, dass der SARS-CoV-2-IgG-Antikörper positiv ist.
Wenn keine der IgG- oder IgM-Banden färbt, ist das Testergebnis negativ. Der Test enthält auch das C-Band zur Qualitätskontrolle, das im Falle eines gültigen Tests violettrot erscheint. Wenn die C-Bande zur Qualitätskontrolle nicht erscheint: Der Test ist auch dann nicht gültig, wenn die Banden zum Nachweis von IgM und / oder IgG erscheinen sollten
KIT-ZUSAMMENSETZUNG
Jede Box enthält 40 Kits.
Jedes Kit enthält: das Gerät, den Puffer, die Pipette (optional) und die Packungsbeilage.
Erforderliche, aber möglicherweise nicht mitgelieferte Materialien: Steriles Stechgerät (für Blut aus den Fingerspitzen), Alkoholtupfer, Uhr / Timer.
LAGERUNG UND EMPFEHLUNGEN FÜR DEN GEBRAUCH
• Lagern Sie das Kit an einem kühlen, trockenen Ort bei einer Temperatur zwischen 2 ° und 30 ° C. Halten Sie es von direkter Sonneneinstrahlung fern. Die Einwirkung einer anderen als der angegebenen Temperatur und / oder Luftfeuchtigkeit kann zu fehlerhaften Ergebnissen führen.
• Nicht einfrieren oder kühlen. Verwenden Sie das Kit bei einer Temperatur zwischen 15 ° und 30 ° C.
• Verwenden Sie das Kit bei einer Luftfeuchtigkeit zwischen 10% und 90%
• Verwenden Sie keine Kits, die über das Verfallsdatum hinausgehen (auf dem Aluminium-Testbeutel und auf der Verpackung aufgedruckt).
Hinweis: Alle Ablaufdaten werden im Format JJJJ-MM Jahr-Monat geschrieben. Zum Beispiel bedeutet 2021-06 Juni 2021.
WARNHINWEISE, VORSICHTSMASSNAHMEN UND NUTZUNGSBESCHRÄNKUNGEN
• Die Ergebnisse der aus dem Test erhaltenen IgM / IgG-Antikörper können NICHT als alleinige Grundlage für die Diagnose oder zum Ausschluss einer SARS-CoV-2-Infektion oder als Information über den Infektionsstatus verwendet werden.
• Negative Ergebnisse schließen eine SARS-CoV-2-Infektion nicht aus, insbesondere bei Personen, die mit dem Virus in Kontakt gekommen sind. Um eine Infektion bei Personen mit positivem Schnelltest auszuschließen, sollten Folgetests mit molekularer Diagnostik und / oder CT in Betracht gezogen werden.
• Positive Ergebnisse können auf eine frühere oder gegenwärtige Infektion mit Nicht-SARS-CoV-2-Coronavirus-Stämmen wie Coronavirus HKU1, NL63, OC43 oder 229E zurückzuführen sein. Follow-up-Tests mit molekularer Diagnostik und / oder CT sollten in Betracht gezogen werden, um das Schnelltestergebnis zu bestätigen.
• Dieser Schnelltest ist nicht für den Heimgebrauch vorgesehen.
• Dieser Schnelltest ist nicht für das Screening von gespendetem Blut vorgesehen.
• Verwenden Sie keine stark hämolytischen Proben.
• Weitere molekulare Diagnostik und / oder CT wird empfohlen, um die tatsächliche physische Situation zu ermitteln
• Verwenden Sie denselben Test nicht erneut. Verwenden Sie das Kit nicht nach Ablauf des Verfallsdatums.
• Verwenden Sie nur menschliches Vollblut (aus einer Vene oder Fingerspitze), Serum oder Plasma als Probe. Befolgen Sie die Packungsbeilage, um genaue Ergebnisse zu erhalten.
• Alle Teile des Kits gelten als biologisch gefährlich und können möglicherweise auch nach Reinigung und Desinfektion Infektionskrankheiten durch durch Blut transportierte Krankheitserreger übertragen. Treffen Sie geeignete Vorsichtsmaßnahmen und befolgen Sie alle geltenden Vorschriften, wenn Sie gebrauchte Testkits entsorgen.
VERFAHREN ZUR DURCHFÜHRUNG DES TESTS
Balancieren Sie das Kit und den Puffer bei einer Temperatur zwischen 15 ° und 30 ° C, bevor Sie mit dem Test beginnen.
Stellen Sie das Gerät auf eine saubere, flache Oberfläche.
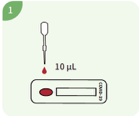
Führen Sie 10 μl Vollblut (aus einer Vene oder Fingerspitze entnommen), Serum oder Plasma in die Vertiefung des Geräts ein.
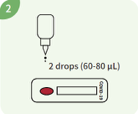
2 Tropfen (ca. 60-80 μl) Puffer in die Vertiefung des Geräts geben
Lesen Sie das Testergebnis in der 15. Minute ab. Lesen Sie das Ergebnis nicht später als 20 Minuten nach Testdurchführung ab.
Hinweis: Gehen Sie vorsichtig mit dem Puffer um und vermeiden Sie jeglichen Kontakt mit Augen oder Haut. Bei Kontakt mit Augen oder Haut: gründlich mit Wasser waschen.
INTERPRETATION DER ERGEBNISSE
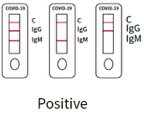 1. Positives Ergebnis
1. Positives Ergebnis
SARS-CoV-2 IgM-Antikörper positiv:
Qualitätskontrolle C-Bande und IgM-Bande färben und erscheinen beide, während die IgG-Bande nicht färbt und nicht erscheint.
SARS-CoV-2 IgG-Antikörper positiv:
Qualitätskontrolle C-Bande und IgG-Bande färben und erscheinen, während die IgM-Bande nicht färbt und nicht erscheint.
SARS-CoV-2 IgM- und IgG-Antikörper positiv:
Alle 3 Banden erscheinen, das C der Qualitätskontrolle und die von IgG und IgM.
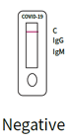 2. Negatives Ergebnis:
2. Negatives Ergebnis:
Nur die C-Bande zur Qualitätskontrolle ist gefärbt und erscheint ohne andere Linien zum Nachweis von IgM oder IgG. Dies zeigt an, dass das Testergebnis sowohl für IgM-Antikörper als auch für SARS-CoV-2-IgG negativ ist.
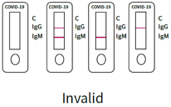 3. Ungültiges Ergebnis:
3. Ungültiges Ergebnis:
Das C-Band für die Qualitätskontrolle wird nicht angezeigt, um anzuzeigen, dass der Test ungültig ist, unabhängig davon, ob die IgG- und IgM-Banden gefärbt sind oder nicht. Sie müssen eine neue Probe entnehmen und einen weiteren Test mit einem neuen Kit durchführen.
QUALITÄTSPRÜFUNG
Interne Verfahrensprüfungen sind im Test enthalten. Ein farbiges Band, das im Kontrollbereich (C) erscheint, ist eine interne Verfahrenskontrolle und bestätigt, dass das Probenvolumen ausreichend ist und die richtige Verfahrenstechnik angewendet wird. Kontrollstandards werden mit diesem Kit nicht mitgeliefert. Es wird jedoch empfohlen, die positiven und negativen Kontrollen als gute Laborpraxis zu testen, um das Testverfahren zu bestätigen und die Durchführung des Tests zu überprüfen.
KONTAKT
DOJA T∙E∙C
Vertriebs- und Beratungsgesellschaft mbH
Schillerstraße 20
72144 Dusslingen / Germany
Telefon: +49 7072 9293 0
Fax: +49 7072 9293 33
E-Mail: Enable JavaScript to view protected content.
